Chimie Minérale Pharmaceutique
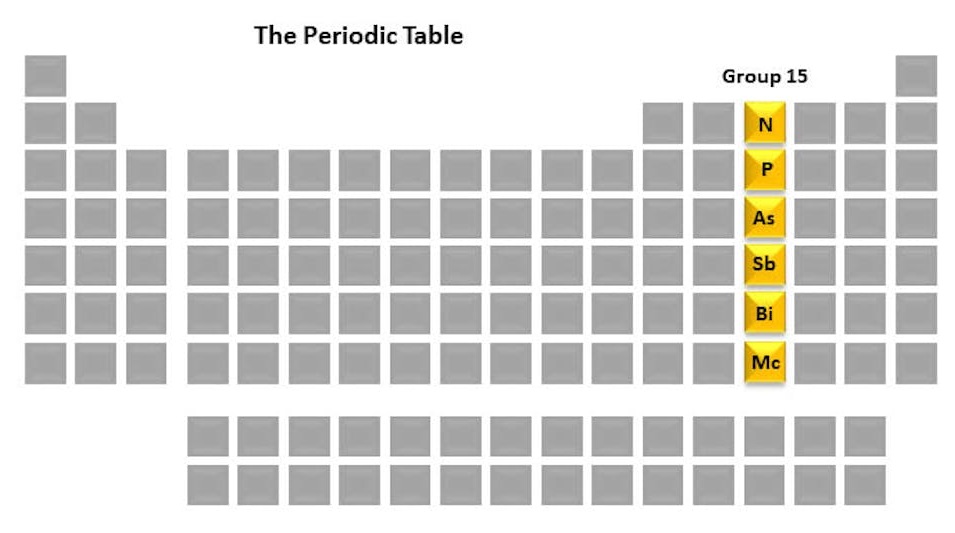
Le groupe 15 du tableau périodique, aussi appelé groupe des pnictogènes, comprend l'Azote (N), le Phosphore (P), l'Arsenic (As), l'Antimoine (Sb) et le Bismuth (Bi). Ces éléments montrent une diversité marquée de comportements chimiques allant des non-métaux aux métaux, avec une importance majeure en biologie, en pharmacie et en industrie.
- Enseignant: Youcef YAHIA
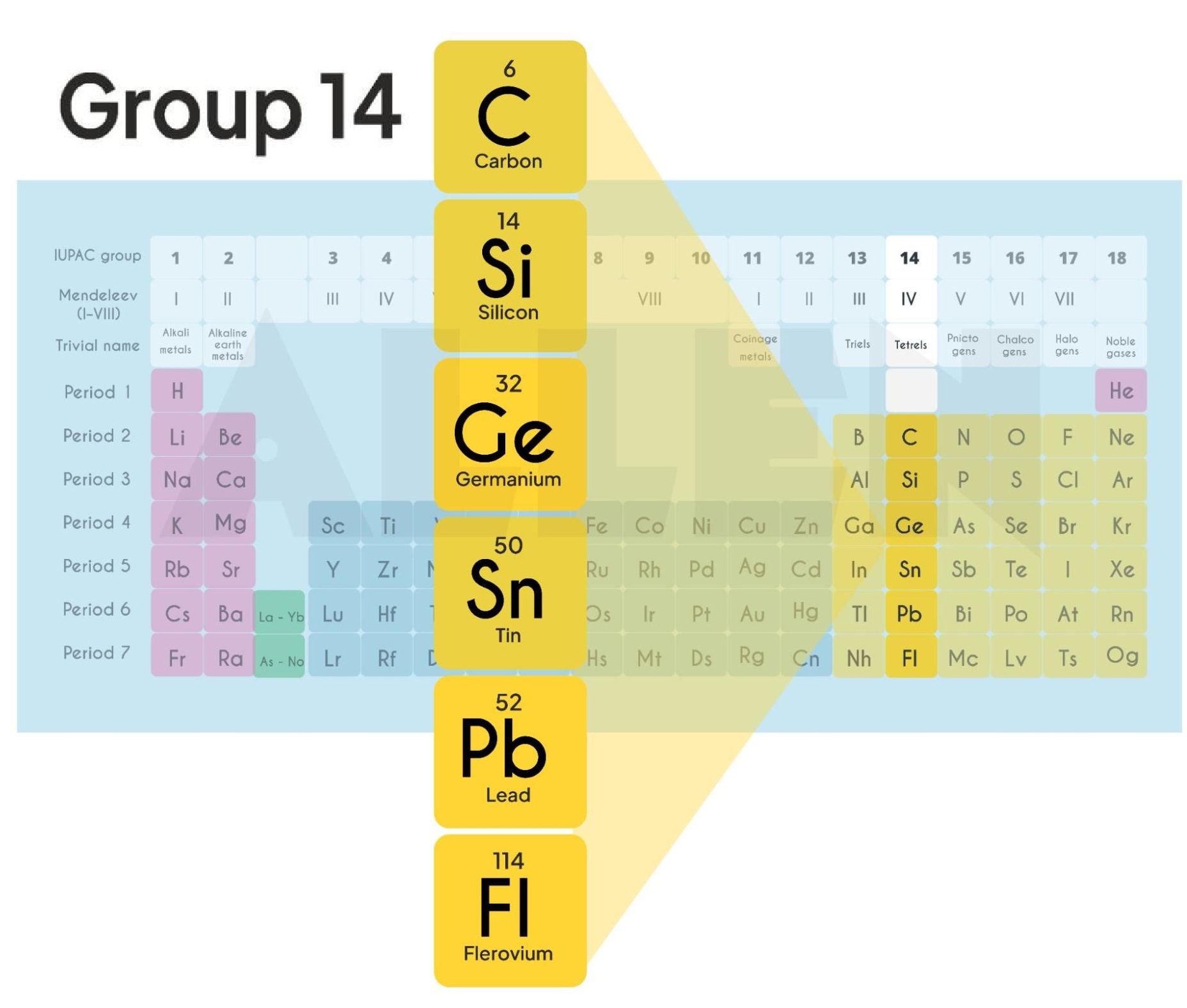
Les éléments du groupe 14 du tableau périodique (Carbone, Silicium, Germanium, Étain, Plomb) possèdent quatre électrons de valence, ce qui leur confère une grande variété de comportements chimiques allant du non-métallique au métallique. Leur étude est essentielle pour comprendre de nombreux phénomènes naturels et industriels, ainsi que pour certaines applications pharmaceutiques.
- Enseignant: Youcef YAHIA
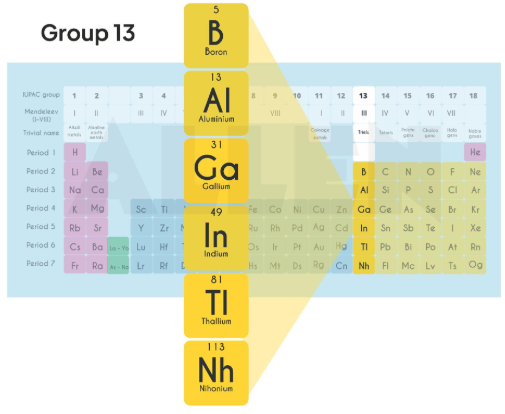
Les éléments du groupe 13 du tableau périodique (Bore, Aluminium, Gallium, Indium, Thallium) présentent des propriétés chimiques et physiques intéressantes, avec des applications importantes en pharmacie et en médecine. Leurs études permettent de mieux comprendre la variabilité des comportements chimiques au sein d’un même groupe, ainsi que leurs usages et leurs effets.
- Enseignant: Youcef YAHIA
Les étudiants qui ont manqué leurs TP ont une session de rattrapage programmée pour jeudi. Si vous manquez cette séance, vous obtiendrez un zéro. Si vous avez une justification des séances manquées, veuillez me l'envoyer par e-mail.
- Enseignant: Ali BELHACHEM
- Enseignant: Ali BELHACHEM
L’analyse qualitative minérale permet la détermination de la nature des ions contenus dans une solution. En identifiants ces ions à l’aide des réactifs d’identifications caractéristiques.

- Enseignant: Ali BELHACHEM
L’analyse qualitative minérale permet la détermination de la nature des ions contenus dans une solution. En identifiants ces ions à l’aide des réactifs d’identifications caractéristiques.

- Enseignant: Ali BELHACHEM
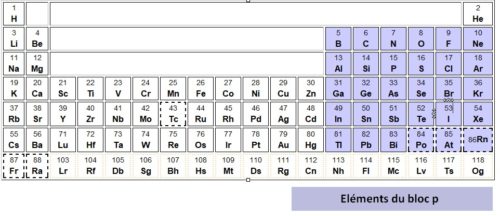
Le bloc p est situé sur le bord droit du tableau périodique et contient les éléments chimiques des 13e, 14e, 15e, 16e, 17e et 18e groupes du tableau, à l'exception de l'hélium, qui appartient au bloc s.
Le bloc p renferme la plus grande diversité d'éléments. C'est le seul qui contient à la fois des éléments solides, liquides (le brome) et gazeux à l'état standard. C'est également le seul qui contient à la fois des métaux, des métalloïdes et des non-métaux. Tous ces éléments sont caractérisés par le fait que la sous-couche d'énergie la plus élevée de leurs électrons de valence à l'état fondamental est de type p,
- Enseignant: Ali BELHACHEM
L’analyse qualitative minérale permet la détermination de la nature des ions contenus dans une solution. En identifiants ces ions à l’aide des réactifs d’identifications caractéristiques.

- Enseignant: Ali BELHACHEM
La mise en solution des composés solides implique le processus de dissolution, où un solide se dissout dans un liquide pour former une solution. Ce processus dépend de plusieurs facteurs, notamment la nature du solide, du liquide et des conditions environnementales.

- Enseignant: Ali BELHACHEM
Les éléments ou métaux de transition forment le bloc d du tableau de Mendeleïev, leur configuration électronique est caractéristique : ils possèdent en général deux électrons s dans la couche externe et un nombre croissant d’électrons dans une sous-couche d.
En passant d’un métal de transition à un autre, ce n’est pas la couche externe mais une couche interne qui se modifie, les différences entre les propriétés d’un élément et celles de ses voisins sont moins prononcées que dans les principaux groupes.
- Enseignant: Ali BELHACHEM
Les verreries et le matériel de laboratoire sont des éléments essentiels dans de nombreux domaines scientifiques tels que la chimie, la biologie, la physique et les sciences de la santé. Ils sont utilisés pour effectuer des expériences, des analyses et des manipulations diverses.

- Enseignant: Ali BELHACHEM
Les travaux pratiques de chimie inorganique pharmaceutique sont des activités expérimentales réalisées dans le cadre de l'enseignement ou de la recherche en chimie inorganique appliquée au domaine pharmaceutique. Ces travaux pratiques visent à familiariser les étudiants ou les chercheurs avec les techniques expérimentales et les concepts spécifiques à la chimie inorganique, en mettant l'accent sur les applications dans le domaine pharmaceutique.

- Enseignant: Ali BELHACHEM
L’atome d’hydrogène, le plus simple de tous, est le constituant essentiel de l’univers, son intérêt théorique se double pour le dihydrogène. C’est le premier élément de la classification périodique, n’appartient en réalité à aucun groupe, il est mis arbitrairement dans le groupe I (1s1).
Par certaines de ces propriétés il se rapproche des métaux .il est assez bon conducteur de chaleur. Comme les métaux l’hydrogène donne un ion positif H+.
D’autres parts il possède quelque caractère des halogènes du groupe XVII, il donne comme eux des molécules diatomiques. Il peut donner un ion négatif, en effet les hydrures métalliques sont comparables aux sels des halogènes.
- Enseignant: Ali BELHACHEM
Les métaux alcalino-terreux sont les éléments de la deuxième colonne du tableau périodique. Sous forme élémentaire, ils forment des structures solides métalliques. Ils possèdent deux électrons de valence qui se trouvent dans les orbitales s. A l’état métallique les alcalinoterreux sont des solides de couleur argenté, plus dur et plus dense que les métaux alcalins, ductiles et malléables
- Enseignant: Ali BELHACHEM
Les métaux alcalins, comprenant le lithium, le sodium, le potassium, le rubidium, le césium et le francium, se caractérisent par leur réactivité élevée et leur capacité à former des ions positifs. Leur texture métallique, faible point de fusion et densité relativement basse les distinguent. Certains métaux alcalins, comme le sodium et le potassium, sont utilisés dans l'industrie chimique. Ils produisent des flammes caractéristiques lorsqu'ils sont chauffés, utilisées pour l'identification. Certains, comme le césium, peuvent être toxiques. Le césium est utilisé dans les horloges atomiques, et le rubidium dans la recherche scientifique.
Les métaux alcalins, tels que le potassium et le lithium, ont des applications médicales significatives. Le potassium est essentiel à la fonction cellulaire et est souvent utilisé en médecine pour traiter les déséquilibres électrolytiques. Il est présent dans les solutions intraveineuses pour traiter les patients souffrant de carences en potassium. Le lithium est utilisé comme médicament psychotrope pour traiter les troubles bipolaires. Il agit en stabilisant l'humeur en modulant les niveaux de neurotransmetteurs. Ces applications soulignent l'importance des métaux alcalins dans le maintien de l'équilibre ionique et dans le traitement des troubles neuropsychiatriques. Cependant, l'utilisation de ces métaux en médecine nécessite une gestion précise en raison de leurs propriétés réactives.

- Enseignant: Ali BELHACHEM
Exercises in english of Pharmaceutical Mineral Chemistry for the academic year 2025-2026.
- Enseignant: Zoheir BENTOUNSI
L’analyse qualitative minérale permet la détermination de la nature des ions contenus dans une solution. En identifiants ces ions à l’aide des réactifs d’identifications caractéristiques.

- Enseignant: Ali BELHACHEM
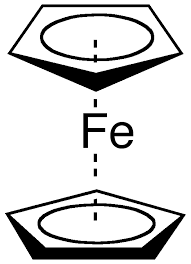
Cours 4 de chimie minérale pharmaceutique assuré en présentiel le 19-10-2025 ,consacré à un rappel sur les différents types de composés organométalliques.
Course 4 in Pharmaceutical Inorganic Chemistry, given face-to-face on 19-10-2025, focusing on the different types of organometallic compounds.
- Enseignant: Zoheir BENTOUNSI
Cours 3 de chimie minérale pharmaceutique assuré en présentiel le 12- 10-2025.
La famille des gaz nobles sera étudiée ainsi que certaines de leurs réactions caractéristiques .
Course 3 in Pharmaceutical Inorganic Chemistry given face-to-face on 12 -10-2025.
The family of noble gases will be studied as well as some of their characteristic reactions.
- Enseignant: Zoheir BENTOUNSI
Cours 2 chimie minérale assuré en présentiel le 05-10 -2025. Durant ce cours les différentes propriétés périodiques des éléments ainsi que leurs évolution au sein du tableau de MENDELEIV seront abordés.
Course 2 inorganic chemistry given in-person classes on 05-10-2025. During this course the different periodic properties of the elements as well as their evolution within the MENDELEIV table will be discussed.
- Enseignant: Zoheir BENTOUNSI
